Através da fotossíntese, as plantas convertem a luz solar, água e CO2 em açúcares, multicarbon moléculas que os processos de combustível celular. CO2 é, portanto, tanto o precursor para os combustíveis fósseis que são centrais para a vida moderna, bem como o subproduto da queima desses combustíveis. A capacidade de gerar combustíveis líquidos sintéticos estáveis, de precursores de carbono oxigenados, como o CO2 e monóxido de carbono (CO) é uma reminiscência de fotossíntese na natureza e é uma transformação que é desejável em sistemas artificiais. Durante cerca de um século, um método químico conhecido como o processo de Fischer-Tropsch tem sido utilizada para converter o gás hidrogénio (H2) e de CO para combustíveis líquidos. No entanto, o seu mecanismo não é bem compreendida e, em contraste com a fotossíntese, o processo requer pressões elevadas (a partir de 1 a 100 vezes a pressão atmosférica) e temperaturas (100-300 graus Celsius).
Mais recentemente, têm sido relatados químicas alternativos de conversão para a produção de combustíveis líquidos a partir de precursores de carbono oxigenados. Usando electrocatalisadores cobre, CO e CO2 podem ser convertidos em produtos multicarbon. O processo prossegue sob condições suaves, mas como ele ocorre permanece um mistério.
Agora, o professor de química Caltech Theo Agapie e seu aluno de pós-graduação Joshua Buss ter desenvolvido um sistema modelo para demonstrar o que os passos iniciais de um processo para a conversão de CO para hidrocarbonetos pode parecer.
Os resultados, publicados como uma publicação em linha avançada para a revista Nature em 21 de Dezembro, 2015 (e que aparecem na imprensa em 7 de Janeiro, 2016), fornecem uma base para o desenvolvimento de tecnologias que podem um dia ajudar a neutralizar os efeitos negativos da acumulação atmosférica da estufa de gás CO2, convertendo-lo de volta em combustível. Embora existam métodos para transformar o CO2 em CO, um próximo passo crucial, a desoxigenação de moléculas de CO e o seu acoplamento para formar ligações C-C, é mais difícil.
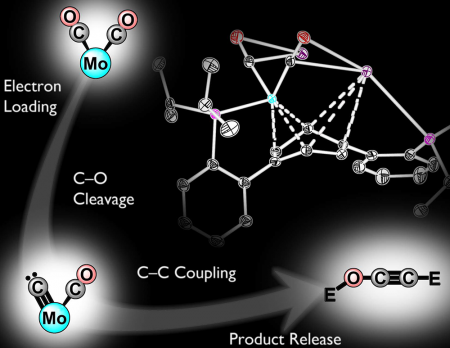
No seu estudo, Agapie e Buss sintetizado um novo complexo de metal de transição-um átomo de metal, neste caso de molibdénio, ligados por uma ou mais moléculas de suporte conhecidas como ligantes que podem facilitar a activação e clivagem de uma molécula de CO. Uma redução incremental da molécula conduz ao enfraquecimento substancial das ligações C-O de CO. Uma vez enfraquecido, a ligação é quebrada inteiramente através da introdução de electrófilos sililo, uma classe de reagentes contendo silício que podem ser usados como substitutos para protões.
Esta clivagem resulta na formação de um carboneto de-um único átomo de carbono terminal ligado a um centro de metal-que subsequentemente faz uma ligação com a segunda molécula de CO coordenados ao metal. Embora um carboneto é comumente proposto como um intermediário na redutiva acoplamento CO, esta é a primeira demonstração directa de seu papel neste tipo de química, os pesquisadores. Após a formação da ligação C-C, o centro metálico liberta o produto C2. Em geral, este processo converte as duas unidades do co a um derivado etinol e prossegue facilmente, mesmo a temperaturas mais baixas que a temperatura ambiente.
"Para o nosso conhecimento, este é o primeiro exemplo de uma reação bem definida que pode ser de duas moléculas de monóxido de carbono e convertê-los em um derivado etinol livre de metal, uma molécula relacionada com etanol; o fato de que nós podemos liberar o produto C2 a partir de o metal é importante ", diz Agapie.
Embora o derivado de etinol gerado não é útil como um combustível, que representa um passo para ser capaz de gerar multicarbon combustíveis sintéticos a partir de dióxido de carbono. Os investigadores estão agora a aplicar o conhecimento obtido neste estudo inicial para melhorar o processo. "Idealmente, a nossa visão vai facilitar o desenvolvimento de sistemas práticos catalíticos", diz Buss.
Os cientistas também estão trabalhando em uma maneira de clivar a ligação C-O utilizando prótons em vez de eletrófilos sililo. "Em última análise, nós gostaríamos de usar prótons de água e electrões equivalentes derivados de luz solar", diz Agapie. "Mas prótons são muito reativos, e agora não podemos controlar essa química".